在即将到来的China Focus(2020年1月12日,旧金山,凯悦酒店)上,我们有幸邀请到Genetech前科学家H. Michael Shepard博士作为特别演讲嘉宾,他将与我们分享“赫赛汀的研发过程”的精彩内容。如果希望参会China Focus,请直接跳转至文末,进行注册报名。
Shepard博士专注癌症靶向治疗研究20余年,特别在乳腺癌治疗领域做出过卓越贡献。我们可以通过Shepard博士获得被誉为“诺贝尔奖风向标”的“拉斯克奖”来一同了解他的科研故事。



▲2019年拉斯克-德巴基临床医学研究奖获奖者,来源:Lasker Foundation
9月10日,在生物医学领域享有盛誉,被誉为“诺贝尔奖风向标”的拉斯克奖(Lasker Prize)正式公布。基因泰克前科学家H. Michael Shepard、加州大学洛杉矶分校的Dennis J. Slamon与德国马克普朗克研究所的Axel Ullrich因发明赫赛汀并应用于乳腺癌治疗获得拉斯克-德巴基临床医学研究奖;美国埃默里大学的Max D. Cooper和澳大利亚生物学家Jacques Miller因发现免疫B细胞和T细胞获基础医学研究奖;国际组织全球疫苗免疫联盟(Gavi)获得拉斯克-布伦伯格公共服务奖。作为美国顶级生物医学奖项,拉斯克奖从1946年开始颁发,截止目前,全球已经有超过300人荣获该奖项,而获奖者中已产生88位诺贝尔奖得主。我国诺贝尔生理学或医学奖得主屠呦呦,也曾于2011年荣获拉斯科临床医学研究奖。
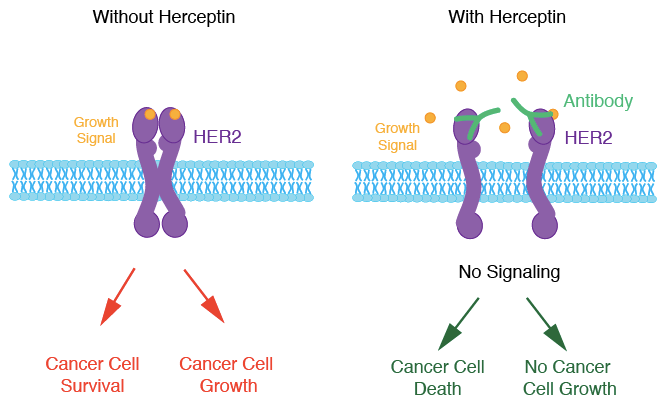


▲曲妥珠单抗作用机制,来源:Caitlin Nichols, The Elephant inthe Room: Gene Copy Number and Cancer, Science in the News
此次获奖的赫赛汀(Herceptin,通用名曲妥珠单抗,Trastuzumab)是人类抗癌史上的重要里程碑。赫赛汀作为第一款靶向致癌基因的单抗药物,其出现不仅拯救了无数乳腺癌患者的生命,更引发了随后全球抗癌靶向药的研发热潮。在罹患乳腺癌的女性中,约有25%的患者肿瘤出现人类表皮生长基因受体²(HER2/ERBB2/neu)基因扩增(HER2阳性)。此类乳腺癌侵袭性强、恶性度高,且对化疗、内分泌治疗不敏感,其患者生存期短,预后差。而赫赛汀可特异结合HER2胞外段,并通过阻断HER2同源二聚体组成性激活、防止细胞内酪氨酸激酶活化等机制,抑制肿瘤细胞的增殖、促进肿瘤细胞凋亡,降低乳腺癌早期和转移肿瘤患者的复发风险并延长生存时间。自1998年赫赛汀上市以来,已有超过230万人接受治疗。同时,多家药企也开发出了新型HER2靶向抗癌药,如帕妥珠单抗(Pertuzumab,商品名Perjeta)、来那替尼(Neratinib,商品名Nerlynx)、拉帕替尼(Lapatinib,商品名Tykerb)等。基于赫赛汀开发的新型抗体-药物偶联物,如ado-trastuzumab emtansine(商品名Kadcyla)、trastuzumab deruxtecan (DS-8201,仍在III期试验中)也对乳腺癌取得了较好的疗效。在2014年的一项包含4046名HER2阳性乳腺癌患者的研究中⁴,赫赛汀配合化疗使患者十年总生存率从单独化疗的75.2%提高至84%。而另一项2015年的研究显示⁵,帕妥珠单抗、赫赛汀加多西他赛联合治疗可提高晚期HER2阳性乳腺癌患者中位数总生存期从赫赛汀加多西他赛的40.8个月至56.5个月。
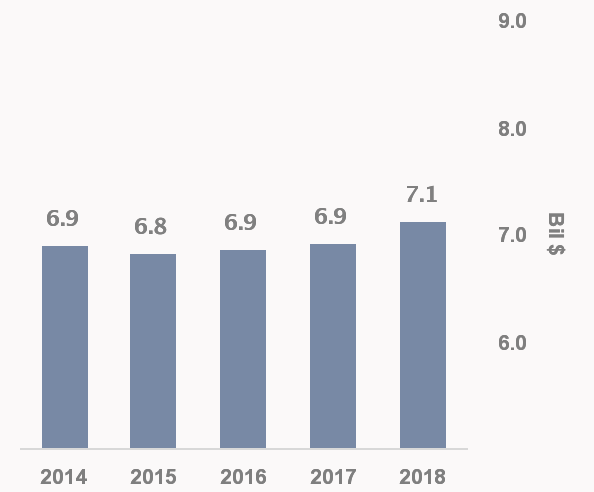


▲赫赛汀年销售额,来源:Forbes
赫赛汀是21世纪最成功的药物之一,其年销售额在上市多年后依然保持在近70亿美元,长期位列药物销售前十名单。赫赛汀于2002年获批进入中国治疗HER2阳性乳腺癌,于2012年增加HER2阳性胃癌适应症,并于2017年纳入医保。据估算,曲妥珠单抗在中国市场空间接近150亿元人民币6。赫赛汀专利已于2014年在欧洲到期,并于今年6月在美国到期。目前,美国已批准5个赫赛汀生物类似物,其中Amen和Allergan公司生产的Kanjinti已经上市。当前国内有13家药企在研发赫赛汀生物类似物,其中三生国健CXSS1800023与复宏汉霖HLX02作为第一梯队已提交上市申请。
值赫赛汀获奖之际,《细胞》、《新英格兰医学杂志》也刊文回顾了赫赛汀研发的曲折历程。其中,作为癌症治疗领域的先驱,获奖者H Michael Shepard博士为赫赛汀的发明做出了卓越的贡献。
Shepard于1977年于印第安纳大学伯明顿校区获分子、细胞与发育生物学博士学位,并于1980年加入基因泰克。在工作的头几年,Shepard的课题集中于人类干扰素、胞浆素原活化物与肿瘤坏死因子(tumor necrosis factor, TNF/TNFα)的克隆。随后,Shepard在基因泰克领导成立了2项极其成功的项目。第一个项目中,Shepard主导了基因泰克与多个大学实验室的合作,而其中最成功的案例便是与Marc Feldmann合作对类风湿关节炎的研究。彼时Feldmann博士正与Ravinder N. Maini合作研究炎性介质在类风湿关节炎中的作用。他们发现类风湿关节炎滑膜组织样本在体外培养中可持续产生炎性介质长达6天,而在正常的发炎反应中该过程只持续数小时至1-2天。在Shepard的帮助下,研究人员发现TNF抗体可以抑制多种如IL-1,IL-6,GM-CSF的炎性介质的产生,并确认了TNF在类风湿关节炎中的重要调节作用。这些发现引发了TNF拮抗剂的研发热潮,并使得英夫利昔单抗(Infliximab),阿达木单抗(Adalimumab)等类风湿关节炎药物得以问世。



▲Shepard在发现肿瘤细胞系对TNF的抗性后对“自分泌生长假说”做出的补充,来源:[8]
Shepard领导的第二个项目,其目标是开发高选择性的癌症疗法,而赫赛汀便是其主要成果。在1985年,只有治疗绒毛膜癌的甲氨蝶呤(Methotrexate)和治疗睾丸癌的顺铂(Cisplatin)具有一定选择性,然而患者对此类疗法的反应却无法预测。因此,Shepard把寻找可以预测患者对药物反应的生物标志物作为第一策略,而此时的他将眼光投向了TNF。TNF在有“现代肿瘤免疫学之父”之称的Lloyd Old的早期研究中使小鼠移植MethA纤维肉瘤发生了消退。然而,Shepard在基因泰克的同事David Goeddel却发现重组人类TNF在患者体内有较强毒性,导致其临床研发中止。而Shepard也发现约有2/3的肿瘤细胞系对重组人类TNF有抗性。这样的结果并没有让Shepard沮丧,因为他意识到对TNF的抗性可能是肿瘤的一个重要特征。其后,在与Hans Schruiber的合作中,Shepard发现TNF是巨噬细胞的效应因子,而早期肿瘤细胞需要产生对TNF的抗性才能进一步发展其侵袭性。这也解释了为什么在Shepard先前的实验中大量肿瘤细胞系对TNF有抗性。此后,Shepard把肿瘤细胞的TNF抗性与Sporn和Todaro提出的“自分泌生长假说”联系在了一起,即肿瘤自分泌和旁分泌生长因子以获得不受控生长能力。在实验中,Shepard发现如果将对TNF敏感的肿瘤细胞系与表皮生长因子和其他几种因子联合培养,则可以抑制TNF 95%以上的细胞毒性。这一系列结果使得Shepard认定活化的受体酪氨酸激酶可以作为抗癌药物的靶标。


▲赫赛汀分子结构,来源:CancerQuest
与此同时,Shepard当时在基因泰克的同事Axel Ullrich也通过和Dennis Slamon(另外的两位获奖者)的合作,确认了HER2与乳腺癌的高度关联性。双方一拍即合。当时Ullrich实验室已经开发出了高度表达HER2的细胞系,同时基因泰克的Bryan Fendly也完成了对HER2胞外段的备选抗体库的制备。在紧张的筛查后,Shepard和同事确认HER2的高度表达的确可以引发TNF抗性,并发现了4D5,一种对体内、体外肿瘤细胞生长都有抑制作用的抗体。4D5同时可以恢复HER2过表达肿瘤细胞对TNF的敏感性。更重要的是,Shepard和同事发现4D5仅在HER2过表达超过30倍的肿瘤细胞系中起作用。这也成为了未来赫赛汀适用性测试(如HecepTest)的理论基础。而4D5的人源化,依靠的则是另一位基因泰克科学家Paul Carter。Carter在Shepard的指导下发明了“6-pack mutagenesis技术”,并成功生成其后进入临床试验的HuMAb4D5抗体。团队成员决定为这个抗体起一个名字,为了体现这一药物的本质,其名字融合了HER2、拦截(intercept)和抑制剂(inhibitor)这三个英文单词,即Herceptin(赫赛汀)。



▲赫赛汀艰辛的研发过程被拍成了电影《Living Proof》(中文译名:生存证明),来源:IMDb
即使已经有了可以测试的HuMAb4D5,基因泰克却因风险考量决定停止HER2项目,这也使得项目来到了生死边缘。那段时间,Slamon经常来到基因泰克的办公楼拦下路人,向他们介绍HER2项目令人印象深刻的研究数据。令人绝望的情况直到基因泰克副总裁Bill Young因母亲罹患乳腺癌转转而支持HER2项目才得到反转。赫赛汀的第一次临床实验却并不顺利,很多患者的疗效不理想,参与的37人中只有5人完成了6个月的实验。然而其中的一位患者Barbara Bradfield却获得了很好的疗效。消息不胫而走,大量无药可治的乳腺癌患者也纷纷表示自愿参加临床试验。在各方的努力下,基因泰克终于在1995年发起了三个独立的三期临床试验,而最为有名的则是“648”试验。在1998年发布的试验结果中,赫赛汀令一半患者的肿瘤缩小了,而在对照组,只有1/3的患者肿瘤缩小。乳腺癌的病程进展则被延迟了四到七个半月。
1998年9月,美国FDA批准了赫赛汀上市。因赫赛汀的发明,Shepard于2007年获得哈佛医学院颁发的Warren Alpert Prize,并于今年获得拉斯克-德巴基临床医学研究奖。
Shepard在离开基因泰克后成立了Canji/Shering-Plough ResearchInstitute并担任副总裁、首席科学官。Canji是首个完成FDA基因治疗审批流程(包含Recombinant DNA ActivitiesCommittee)的公司。Canji研发的adenovirus-p53(可编码p53肿瘤抑制基因的腺病毒)曾进入临床三期试验,用于治疗耐药性卵巢癌。Shepard 推动了Schering-Plough与的合作,后者于1996年以5.5千万美金股票收购了Canji。Shepard于1997年成立了NewBiotics并担任首席科学官。NewBiotics发明了一类称为Enzyme Catalyzed TherapeuticAgents(ECTA)的新疗法。ECTA化合物可以被p53抑制的肿瘤细胞中过表达的酶激活。NewBiotics还开发了第一款可针对多个人类表皮生长基因受体的拮抗剂(目前由Symphogen研发)。 2003年,Shepard创立Receptor BioLogix,并研发靶向驱动表皮生长因子家族的所有11个配体的Fc 融合蛋白异聚体。Receptor BioLogix被Symphogen收购后,Shepard于2009年以首席科学官身份加入Halozyme Therapeutics,并专注于通过调节肿瘤微环境治疗胰腺癌和非小细胞肺癌。Shepard深度参与了Halozyme Therapeutics的聚乙二醇化重组人透明质酸酶(PEGPH20)研发项目,以及多个ENHANZE药物输送技术的合作以及药物审批项目。目前,Shepard博士已发表94篇论文,持有超过50项专利,并在多个基金会、生物技术公司与科研机构担任董事会成员。
在即将到来的China Focus上,我们有幸邀请到Shepard博士作为特别演讲嘉宾。让我们共同期待Shepard博士分享他的科研故事。
· 路演专场专为创新项目、投资机构、大型药企、政府园区等在投融资与技术转让对接搭建平台;
·“一对一”对接专场的设置,便于中外投资机构与创新项目间更高效率的对接洽谈与深度了解合作;
· 展览专场精心挑选项目、资源平台与律所、CRO等服务机构。
· 邀请众多知名药企与投资机构高管参与的主论坛和分论坛,话题聚焦在“未来时间周期内医健大势研判”、“中外医健政策的权威解读”、“跨国巨头药企生存之道的经验分享”等,是全球顶尖生物医药KOL思想碰撞的地方。
识别二维码,进入注册报名页面
中方注册、路演、展览咨询
中方企业赞助咨询





评论